Набор для приготовления полногеномных библиотек ShotGun «SG GM»
Raissol
68250,00
р.
Набор реагентов SG_GM от Raissol® представляет собой полноценную систему ферментативной подготовки библиотек по технологии "ShotGun Sequensing" - простые манипуляции позволяют получать фрагментированную ДНК в диапазоне от 130bp из геномной ДНК или ДНК ампликонов с длинной более 800bp.
Регулирование размеров можно осуществить за счет изменения времени этапа фрагментирования, а для процессирования фрагментированной ДНК нет необходимости очищать ее после этапа фрагментации - этапы репарации и лигирования осуществляются в одной пробирке последовательно. Очистку после этапа лигирования рекомендуется производить с использованием магнитных частиц по технологии SPRI (важно учитывать рекомендации производителя по количеству вносимых частиц на необходимый размер фрагментированной ДНК). Индексирование осуществляется посредством ПЦР - система совместима с индексированными праймерами по технологии Illumina TrueSeq.
Рекомендуется 8 циклов ПЦР индексирования, однако допустимы изменения в зависимости от необходимых показателей финальной концентрации ДНК и относительного количества дупликатов. Очистку после этапа индексирования рекомендуется производить с использованием магнитных частиц по технологии SPRI (важно учитывать рекомендации производителя по количеству вносимых частиц на необходимый размер фрагментированной ДНК).
Регулирование размеров можно осуществить за счет изменения времени этапа фрагментирования, а для процессирования фрагментированной ДНК нет необходимости очищать ее после этапа фрагментации - этапы репарации и лигирования осуществляются в одной пробирке последовательно. Очистку после этапа лигирования рекомендуется производить с использованием магнитных частиц по технологии SPRI (важно учитывать рекомендации производителя по количеству вносимых частиц на необходимый размер фрагментированной ДНК). Индексирование осуществляется посредством ПЦР - система совместима с индексированными праймерами по технологии Illumina TrueSeq.
Рекомендуется 8 циклов ПЦР индексирования, однако допустимы изменения в зависимости от необходимых показателей финальной концентрации ДНК и относительного количества дупликатов. Очистку после этапа индексирования рекомендуется производить с использованием магнитных частиц по технологии SPRI (важно учитывать рекомендации производителя по количеству вносимых частиц на необходимый размер фрагментированной ДНК).
Раздел: Наборы для приготовления ДНК библиотек
В набор включены все необходимые реагенты для приготовления полногеномных библиотек:
1. 3 в 1 буфер;
2. 3-фермент;
3. ДНК-нуклеаза;
4. Лигазный буфер;
5. Лигаза;
6. Адаптеры;
7. ПЦР буфер;
8. ПЦР фермент 1;
9. ПЦР фермент 2.
1. 3 в 1 буфер;
2. 3-фермент;
3. ДНК-нуклеаза;
4. Лигазный буфер;
5. Лигаза;
6. Адаптеры;
7. ПЦР буфер;
8. ПЦР фермент 1;
9. ПЦР фермент 2.
Проведение процедуры приготовления полногеномных библиотек
Фрагментация1. Внести 10 мкл образца ДНК с концентрацией 20 нг/мкл (для геномной ДНК) или 10 нг/мкл (для ампликонов) в пробирки в стрипах либо в 96-луночный планшет объемом 0,2 мл. Концентрация должна быть установлена: 1) для геномной ДНК – спектрофотометрически при длине волны 260 нм 2) для ампликонов – спектрофотометрически с применением интеркаляторов (#spectrahs-100/500/1000; #spectrabr-100/500/1000).
2. Приготовить мастер-микс на необходимое количество реакций:
3в1 буфер - 13,4 мкл на 1 реакцию.
3-фермент - 1,6 мкл на 1 реакцию.
ДНК-нуклеаза - 1 мкл на 1 реакцию.
3. Перемешать мастер-микс, сбросить капли с помощью кратковременного центрифугирования.
4. Внести 16 мкл мастер-микса к образцам.
5. Поместить пробирки в амплификатор с предварительно установленной программой для фрагментации после выхода прибора в рабочее состояние 1-го этапа:
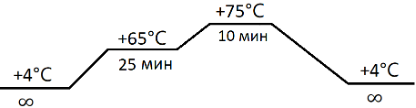
6. После установки пробирок в амплификатор необходимо пропустить первый этап.
Примечание: при использовании ДНК-нуклеазы для фрагментирования ДНК на необходимый размер следует провести предварительное тестирование времени фрагментации (полка 2: +65℃) с шагом 2,5 минуты для установления оптимального размера (уменьшение времени приводит к увеличению размера продукта). Рекомендованная программа рассчитана на средний размер продукта 140-160 п.н.
Лигирование
1. Приготовить мастер-микс на необходимое количество реакций:
Лигазный буфер - 20,5 мкл на 1 реакцию.
Адаптеры - 3,5 мкл на 1 реакцию.
Лигаза - 1 мкл на 1 реакцию.
2. Перемешать мастер-микс, сбросить капли с помощью кратковременного центрифугирования.
3. После завершения программы фрагментации внести 25 мкл мастер-микса к образцам.
4. Установить программу для лигирования. Поместить пробирки в амплификатор с предварительно установленной программой для лигирования после выхода прибора в рабочее состояние 1-го этапа:

5. После установки пробирок в амплификатор необходимо пропустить первый этап.
Очистка после лигирования
1. Добавить 45 мкл магнитных частиц к каждому образцу, интенсивно перемешать на вортексе до гомогенного состояния, инкубировать в течение 5 минут при комнатной температуре, сбросить капли с помощью кратковременного центрифугирования.
2. Поместить образцы на магнитный штатив, инкубировать в течение 3-5 минут до прозрачности раствора.
3. Аккуратно, не задевая осадок частиц, удалить супернатант.
4. Добавить 180 мкл 80% этанола к каждому образцу, инкубировать в течение 30 секунд, перемещая пробирки на магнитном штативе, меняя их положение относительно магнита. Аккуратно, не задевая частицы, удалить супернатант.
5. Повторить пункт 4. Высушить образцы с открытыми крышками при комнатной температуре в течение 10 минут или при +37℃ до полного испарения спирта.
6. Добавить 24 мкл деионизированной воды к осадку частиц. Интенсивно перемешать пробирки на вортексе, сбросить капли с помощью кратковременного центрифугирования.
7. Поместить образцы на магнитный штатив, инкубировать в течение 2-3 минут до прозрачности раствора.
8. Перенести 22 мкл элюата в новые пробирки, не захватывая магнитные частицы.
Постановка индексной ПЦР
1. Добавить к каждому образцу по 2 мкл индивидуального праймерного микса из планшета с праймерами (#Plate1_SG_GM/#Plate2_SG_GM).
2. Приготовить мастер-микс на необходимое количество реакций:
ПЦР буфер - 25 мкл на 1 реакцию.
ПЦР фермент 1 - 0,5 мкл на 1 реакцию.
ПЦР фермент 2 - 0,75 мкл на 1 реакцию.
3. Перемешать мастер-микс, сбросить капли с помощью кратковременного центрифугирования.4. Внести по 26,25 мкл мастер-микса к образцам.
5. Поместить пробирки в амплификатор. Запустить программу для индексной ПЦР:
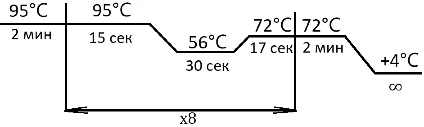
Очистка после индексной ПЦР
1. Добавить 50 мкл магнитных частиц к каждому образцу, интенсивно перемешать на вортексе до гомогенного состояния, инкубировать в течение 5 минут при комнатной температуре, сбросить капли с помощью кратковременного центрифугирования.
2. Поместить образцы на магнитный штатив, инкубировать в течение 3-5 минут до прозрачности раствора.
3. Аккуратно, не задевая осадок частиц, удалить супернатант.
4. Добавить 180 мкл 80% этанола к каждому образцу, инкубировать в течение 30 секунд, перемещая пробирки на магнитном штативе. Аккуратно, не задевая осадок частиц, удалить супернатант.
5. Повторить пункт 4. Высушить образцы с открытыми крышками при комнатной температуре в течение 10 минут или при +37℃ до полного испарения спирта.
6. Добавить 22 мкл TE буфера с низким содержанием ЭДТА к осадку частиц. Интенсивно перемешать пробирки на вортексе, сбросить капли с помощью кратковременного центрифугирования.
7. Поместить образцы на магнитный штатив, инкубировать в течение 2-3 минут до прозрачности раствора.
8. Перенести 20 мкл элюата в новые пробирки.
Полученные полногеномные библиотеки могут храниться при +4℃ в течение суток или при -20℃ более длительный срок. Полногеномные библиотеки могут быть использованы в дальнейшей подготовке к секвенированию.
Скачать краткую инструкцию "ShotGun GM" (pdf)
Скачать полную инструкцию "ShotGun GM" (pdf)
Все реагенты набора «SG GM» необходимо хранить при -20℃, срок хранения составляет 12 месяцев.
Необходимые материалы и оборудование:
- Микроцентрифужные пробирки объемом 1,5-2 мл;
- Штатив для микроцентрифужных пробирок объемом 1,5-2 мл;
- Пробирки в стрипах либо 96-луночный планшет объемами 0,2 мл;
- Автоматические дозаторы переменного объема на 0,5-10 мкл, 2-20 мкл, 20-200 мкл, 100-1000 мкл и соответствующие одноразовые наконечники;
- Вортекс;
- Центрифуга для пробирок в стрипах объемом 0,2 мл; амплификатор;
- Магнитный штатив планшетного типа для пробирок объемом 0,2 мл.
- Магнитные частицы для селективной очистки ДНК, например, «Smart beads» Raissol™ (#smartb 50/120/240), или аналоги технологии SPRI;
- Деионизированная вода;
- ТЕ буфер с низким содержанием ЭДТА;
- 80% этанол;
- Праймеры – комплект индексов 1 (#Plate1_SG_GM);
- Праймеры – комплект индексов 2 (#Plate2_SG_GM).
Смотрите также